Отзыв по оборудованию: кислородный концентратор OXY 6000 (Bitmos GmbH, Германия)
скачать документ в pdfНовые возможности оценки артериальной ригидности – раннего маркера развития сердечно-сосудистых заболеваний
Материалы симпозиума
XIV Российский национальный конгресс «Человек и лекарство» 19 апреля 2007 г., Москва
Под редакцией академика РАМН, профессора А. И. Мартынова
Москва 2007
УДК
Новые возможности оценки артериальной ригидности – раннего маркера развития сердечно-сосудистых заболеваний. Материалы симпозиума. – М.: Издательский дом «Русский врач», 2007. – 48 с.
Под редакцией академика РАМН, профессора А.И.Мартынова
Материалы симпозиума изданы при поддержке компании ЗАО «ЛассаМед».
ISBN
© Государственное образовательное учреждение высшего профессионального образования «МГМСУ РОСЗДРАВА», 2007
© Оформление «Издательский дом «Русский врач», 2007
Содержание
- Список сокращений
- Обращение
- Предисловие
- Артериальное давление и артериальная ригидность в 21-м веке.Теренс Мартин
- Жесткость артериальной стенки и отражение пульсовой волны: связь с установленными и обсуждаемыми детерминантами сердечно-сосудистых заболеваний. Рябиков А.Н., Малютина С.К., Иванов С.В.
- Возможности применения контурного анализа пульсовой волны при неинвазивной оценке структурных изменений сонных и коронарных артерий. Семенкин А.А.
- Состояние сосудов у женщин перименопаузального периода. Майчук Е.Ю., Воеводина И.В, Пиляева Н.Г., Сапунова Д.А.
Уважаемые коллеги!
В соответствии с приоритетным национальным проектом «Здоровье» в ходе работы конгресса «Человек и лекарство» большое внимание было уделено вопросам усиления профилактической направленности здравоохранения, организации доступности высокотехнологичной помощи населению России. В частности, рассматривались вопросы первичной и вторичной профилактики сердечно-сосудистой патологии. Данная группа заболеваний является одной из ведущих причин заболеваемости и смертности в нашей стране и во всем мире. Современная диагностика заболеваний сердечно-сосудистой системы и своевременное лечение могут существенно снизить риск развития инфаркта миокарда, сердечной недостаточности и способствовать увеличению продолжительности жизни.
Метод измерения артериального давления, открытый Н.C. Коротковым сто лет назад, сегодня развивается и приходят новые технологии, позволяющие оценивать ригидность сосудов. Эти инновационные подходы открывают возможности более ранней диагностики атеросклеротического поражения сосудов. В связи с этим все большее практическое значение приобретает поиск методов, позволяющих исследовать новые факторы риска развития и осложнений сердечно-сосудистых заболеваний. Появившиеся в последние годы принципиально новые технологические возможности способствуют внедрению в клиническую практику инновационных методов исследования сердечно-сосудистой системы, среди которых особое место занимает изучение показателей жесткости или ригидности сосудистой стенки методом фотоплетизмографии. Неинвазивность исследования, его информативность и высокий уровень чувствительности и специфичности позволяет рассматривать его, как один из наиболее перспективных диагностических методов исследования сердечно-сосудистой системы.
Опубликованные материалы симпозиума представляют большой интерес для практических врачей и научных сотрудников, работающих в различных областях медицины.
А. Г. ЧУЧАЛИН
Президент конгресса «Человек и лекарство», академик РАМН, профессор, главный терапевт Минздравсоцразвития РФ, директор ФГУ НИИ пульмонологии Росздрава
Предисловие
Сердечно-сосудистые заболевания являются одной из основных причин смертности населения развитых стран. Поэтому раннее выявление факторов риска и начальной, доклинической стадии заболеваний представляет собой актуальную проблему в кардиологии. Ряд крупных исследований последнего десятилетия показал, что жесткость артерий является независимым предиктором развития сердечно-сосудистых заболеваний и сердечно-сосудистой смертности в популяции. Особенно важно, что ее прогностическая ценность высока на доклинических стадиях развития заболеваний.
Сосуды – один из главных органов-мишеней, который поражается при различных заболеваниях. Изменения сосудистой стенки отмечаются при артериальной гипертензии, сахарном диабете, хронической почечной недостаточности, атеросклерозе, старении.
В последних рекомендациях Европейского общества гипертензии (ESH) и Европейского общества кардиологии (ESC)–2007 по проблеме артериальной гипертензии параметрам жесткости сосудистой стенки уделяется большое внимание. Данные показатели включены в число тестируемых параметров при поиске субклинического поражения органов-мишеней при артериальной гипертензии (АГ), а также факторов, серьезно влияющих на прогноз у пациентов с АГ.
Методы оценки эластичности или жесткости артерий приобретают все большую популярность, так как они позволяют оценивать не только структуру, но и функцию сосудов. Для оценки структурно-функционального состояния крупных сосудов применяются прямые визуализирующие (УЗИ, МРТ) и непрямые методики (контурный анализ пульсовой волны, плетизмография, сфигмография, пульсоксиметры и др.). Несомненно, в клинической и амбулаторной практике наиболее привлекательными являются неинвазивные, доступные и легко воспроизводимые методики.
В данном сборнике представлены материалы докладов симпозиума «Новые возможности оценки артериальной ригидности – раннего маркера развития сердечно-сосудистых заболеваний», под председательством академика РАМН, проф. А.Г. Чучалина и академика РАМН, проф. А.И. Мартынова, который состоялся в рамках XIV Российского национального конгресса «Человек и лекарство», г. Москва. В симпозиуме
приняли участие специалисты из разных регионов России, занимающиеся проблемами артериальной гипертензии, атеросклероза, заболеваний коронарных артерий, состояния сердечно-сосудистой системы у женщин в менопаузе. Обсуждались возможности и перспективы неинвазивной методики оценки артериальной ригидности сосудов – контурного анализа пульсовой волны на базе прибора Pulse Trace PCA2 (Micro Medical, Великобритания) при оценке артериальной ригидности и сосудистого тонуса, кардиоваскулярного риска и эффективности лечения. Особое внимание уделялось вопросам достоверности полученных результатов и их клинического применения в повседневной практике специалистов – кардиологов, терапевтов, эндокринологов и врачей др. специальностей.
А. И. МАРТЫНОВ
академик РАМН, профессор
Артериальное давление и артериальная ригидность в 21-м веке Теренс Мартин
Micro Medical Ltd, Великобритания
Достоверный мониторинг АД и правильная постановка диагноза – один из главных факторов, вносящих свой вклад в развитие сердечнососудистой болезни.
Традиционно принятый рутинный осциллометрический метод измерения АД в плечевой артерии при обследовании пациента является столпом современной медицины для последующей оценки риска, подборе антигипертензивных препаратов, оценки их эффективности и адекватности лечения. Однако, несмотря на его глобальное принятие, к измерениям АД в плечевой артерии нужно подходить с осторожностью, так как диагностические и терапевтические заключения, основанные на результатах данного метода измерения, могут быть ошибочными.
Точность осциллометрических приборов имеет свои ограничения. Отсутствует стандартизованная методика измерения артериального давления. Погрешность измерения давления методом Короткова соответствует:
• ? ± 5мм рт.ст. для среднего (FDA);
• ? ± 8мм рт.ст. для систолического и диастолического (FDA).
Метод Короткова имеет погрешность, аналогичную инвазивным методам измерения АД. Таким образом, погрешность систолического и диастолического АД может составлять ±16 мм рт. ст. от истинного реального АД.
Эффект «белого халата» и «маскированная» гипертензия вносят существенный вклад в получение недостоверных данных.
К результатам неинвазивного измерения АД необходимо подходить с осторожностью и принимать во внимание, кто и при каких условиях производил измерение АД [1,2,3]. Единичные клинические измерения АД являются недостоверными и могут приводить к ошибкам при постановке диагноза и ятрогенным осложнениям, поэтому необходимо искать подтверждение наличия повреждений органов-мишеней: ретинопатии, альбуминурии, увеличения креатинина, гипертрофии левого желудочка, увеличения размеров левого предсердия, микроальбуминурии, изменения пульсовой волны или времени распространения пульсовой волны, эндотелиальной дисфункции [4].
Для преодоления и исключения эффекта «белого халата» было предложено проводить измерения АД самим пациентом в домашних условиях, тем самым возложить ответственность за свое здоровье на па
циента. Измерение артериального давления в домашних условиях получило всеобщее одобрение [5]:
• ? преодоление эффекта «белого халата»;
• ? усреднение большого количества записей приводит к уменьшению случайных ошибок и некоторых ограничений осциллометрического метода.
Все большее распространение и поддержку находит мониторирование АД в домашних условиях. Рассмотрим другие параметры, такие как ригидность крупных артерий и центральное АД.
Артериальная ригидность Артериальная ригидность – изменение диаметра сосуда в ответ на изменение давления (см/мм рт.ст.). Артериальная ригидность напрямую связана со скоростью распространения пульсовой волны – Pulse Wave Velocity (PWV), показатель которой является «золотым стандартом» измерения артериальной ригидности и независимым предиктором сердечно-сосудистой смертности у пациентов:
• с сахарным диабетом II типа: Cruickshank K et al. // Circulation, 2002;
• пожилых: Meaume S. et al. // Arterioscler Thromb Vasc Biol, 2001;
• с артериальной гипертензией: Laurent S. et al. Hypertension, 2001;
• с ХПН: Blacher J et al. // Circulation, 1999;
• получающих препараты, влияющие на ригидность: Mahmud & Feely. Cardiovas. Ther., 2003. PWV(carotid/femoral) стал «золотым стандартом» измерения артериальной ригидности.
На данный момент для оценки артериальной ригидности применяется целый ряд параметров, который представлен в таблице 1. С помощью метода «золотого стандарта» и методов, описанных ниже, определяют время распространения пульсовой волны между сонной и бедренной артериями, отношение времени распространения пульсовой волны к расстоянию между двумя исследуемыми отрезками в м/сек. Однако, несмотря на определенные трудности, возникающие при регистрации качественного сигнала пульсовой волны сонной или бедренной артерии, данный метод является достоверным методом оценки артериальной ригидности крупных сосудов и стандартом, относительно которого должны оцениваться другие измерения. На данный момент существует потребность в альтернативном параметре, характеризующем артериальную ригидность, который можно применять не только в клинических, но и амбулаторных условиях.
Таблица 1
Параметры артериальной ригидности
Центральное систолическое давление
Для оценки нагрузки левого желудочка и эффективности терапии клиницисту недостаточно измерения АД в плечевой артерии.
Как известно, по мере удаления от сердца, продвижения от восходящей аорты к периферии отмечается увеличение САД, а ДАД, хотя и незначительно, но снижается, вследствие чего возрастает и пульсовое давление (рис. 1) [8, 9], что связано с волной отражения. В плечевой артерии среднее и ДАД уменьшается ~1мм рт. ст. Вследствие этого САД и ПД выше на ногах и руках, чем в нисходящей аорте. Повышение систолического давления зависит от:
• возраста;
• частоты сердечных сокращений, положения тела, пробы Вальсавы;
• приема вазодилататоров (нитропрепараты GTN снижают центральное систолическое давление на 20 мм рт ст., не влияя на периферическое сопротивление и систолическое давление в плечевой артерии).

Рис. 1. Пульсовое давление увеличивается к периферии. Слева – пульсовая волна давления в восходящей аорте, справа – а. radialis
Вот почему манжеточное давление в плечевой артерии далеко не всегда соответствует давлению в нисходящей аорте. А поскольку величина САД именно в аорте определяет постнагрузку и массу миокарда левого желудочка, корреляция между уровнем САД на плече и показателями смертности имеет более опосредованный характер в сравнении с САД в аорте. Таким образом, центральное АД:
• наиболее чувствительный индикатор сердечной нагрузки;
• различные классы антигипертензивных препаратов по-разному влияют на центральное АД в аорте, при сопоставимом эффекте на уровень АД в плечевой артерии;
• центральное систолическое АД наиболее чувствительный индикатор нагрузки на левый желудочек, зависит от структурно-функциональных изменений сосудистой стенки.
Гипотензивные препараты могут существенно различаться по влиянию на давление и гемодинамику в аорте, несмотря на одинаковое воздействие на артериальное давление в плечевой артерии.
Останавливаясь на последнем пункте, AHA в ноябре 2005 г. опубликовала результаты исследования CAFE, 2073 пациентов с АГ были разделены на группы в зависимости от терапии:
• амлодипин/периндоприл;
• атенолол/тиазид.
Исследование Conduit Artery Function Evaluation (CAFE) явилось подисследованием Anglo-Scandinavian Cardiac Outcomes Trial (ASCOT) и включало 2073 пациента. В исследовании ASCOT сравнивали традиционный режим терапии (b-блокатор±диуретик) и новый режим (антагонист кальция ± ИАПФ). В декабре 2004 г. исследование ASCOT было досрочно завершено. Были выявлены явные преимущества комбинации антагониста кальция с ИАПФ перед традиционными антигипертензивными средствами. Так, частота случаев смерти от всех причин была ниже на 11%, нефатального инфаркта миокарда – на 13%, всех случаев смерти по сердечно-сосудистым причинам – на 24%, фатальных и нефатальных инсультов – на 23% по сравнению с атенололом/тиазидом.
Снижение АД в плечевой артерии было сопоставимым в обеих группах, однако только в группе амлодипин/периндоприл выявлено существенное снижение центрального систолического давления, что заметно отразилось на конечной точке исследования.
Данное исследование показало наибольшую значимость показателя центрального АД над общепринятым показателем АД в плечевой артерии. Центральное АД может быть независимой детерминантой клинических исходов.
Учитывая клиническое значение показателей артериальной ригидности, встает вопрос: почему до настоящего времени методики измерения артериальной ригидности и PWV не стали рутинными в обычной практике? Вопервых, лишь относительно недавно появились ссылки на результаты исследований и, во-вторых, метод измерения артериальной ригидности «золотой стандарт» является достаточно трудоемким и дорогостоящим, требующим специального обучения персонала, как показано выше в таблице 1.
Существуют ли альтернативные методы оценки артериальной ригидности и центрального артериального давления в амбулаторной практике? Измерение центрального систолического давления и оценка ригидности крупных артерий в клинике стало возможным и доступным благодаря приборам, основанным на анализе контура пульсовой волны в пальце или запястье. Научное обоснование использования такого устройства представлено ниже.
Контурный анализ пульсовой волны
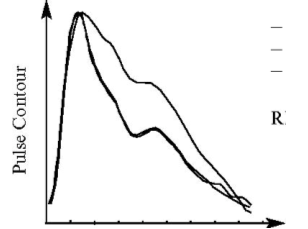
Кривая давления в а.radialis и волна цифрового пульсового объема пальца (DVP), полученная с помощью фотоплетизмографического датчика, довольно близки, но имеют разную форму, как представлено ниже на рис. 2. Однако при преобразовании DVP в радиальный контур давления была выявлена высокая корреляция информации, содержащейся в обеих формах волны.
digital volumt pulse
Radial pulse
Reconstructed radial
pressure RMS error = 1,24 mmHg
0102030405060708090
Рис. 2. Корреляция между кривой давления и кривой объема пальца
Обе пульсовые волны являются результатом суммации прямой и отраженной волн, однако расчетные индексы из соответствующих контуров имеют свои отличия. С помощью кривой радиальной пульсовой волны давления анализируется систолическая часть контура и рассчитываются параметры AIx и Tr (см. рис. 3). Высота систолического пика пульсовой волны зависит не только от артериальной ригидности и сосудистого тонуса, но также от других сердечно-сосудистых параметров, включая время изгнания и ЧСС. С помощью цифрового пульсового объема (DVP) анализируется контур пульсовой волны, соответствующий диастоле, который, в свою очередь, зависит от времени и амплитуды волны отражения, напрямую зависящую от ригидности крупных артерий и сосудистого тонуса, и рассчитываются параметры RI и PPT (SI). Важно отметить, что кривая DVP менее информативна поздней систолы, поэтому параметр AIx не может быть столь полезен при анализе DVP.
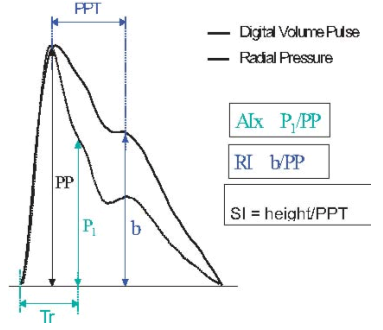
Рис.3. Параметры, рассчитываемые при контурном анализе пульсовой волны
Отмечается высокая корреляция между показателем SI и показателем PWVcf [11] – «золотым стандартом» измерения артериальной ригидности, заболеваниями коронарных артерий [12] и толщиной интимы медиа.
Контурный анализ пульсовой волны является простым и доступным методом оценки артериальной ригидности крупных артерий в клинических условиях.
Резюме
1. Значимость показателя артериальной ригидности в клинической практике неоспорима.
2. В настоящее время существуют новые приборы, позволяющие измерять артериальную ригидность в клинических условиях.
3. Новый подход к объективной оценке эффективности препаратов.
Жесткость артериальной стенки и отражение пульсовой волны: связь с установленными и обсуждаемыми детерминантами сердечно-сосудистых заболеваний
Рябиков А.Н., Малютина С.К., Иванов С.В.
НИИ терапии СО РАМН (ул. Богаткова, 175/1. Новосибирск, 630089)
Введение
Сердечно-сосудистые заболевания (ССЗ) являются одной из основных причин смертности населения развитых стран. Первичная профилактика, проводимая в общей популяции (массовая стратегия), доказала свою эффективность [1]. Предпринимаются попытки сделать профилактические мероприятия более эффективными, выделив из общей популяции группы пациентов с высоким риском (целевая стратегия). В этом направлении применяются два подхода, дополняющие друг друга. С одной стороны, разрабатываются и совершенствуются специальные шкалы, основанные на комплексной оценке (выявлении) известных факторов риска ССЗ (“рискометры”). С другой стороны, усилия специалистов концентрируются на разработке методов выявления начальной стадии заболевания, когда профилактические мероприятия дают максимальный эффект [2]. Преимуществом второго подхода является возможность динамической оценки кардиоваскулярного поражения, в том числе на доклинической стадии, и эффективности лечебных мероприятий. Использование количественных показателей позволяет объективизировать клинические испытания лекарственных средств. Исходя из этого, разработке новых инструментальных способов неинвазивной оценки структурно-функциональных свойств сосудистой стенки на сегодня уделяется большое внимание.
За последнее десятилетие накоплено достаточно данных, свидетельствующих о важности определения жесткости артериальной стенки как показателя, характеризующего сосудистое ремоделирование. Увеличение жесткости стенки крупных артерий и феномен отраженной пульсовой волны являются определяющими патофизиологическими факторами становления изолированной систолической гипертензии и увеличения пульсового давления [3]. В последних рекомендациях (2007) по проблеме артериальной гипертензии от Европейского общества гипертензии (ESH) и Европейского общества кардиологии (ESC) параметры жесткости сосудистой стенки (ЖСС) включены в число тестируемых при поиске субклинического поражения органов-мишеней при артериальной гипертензии (АГ), а также в число факторов, серьезно влияющих на прогноз у пациентов с АГ [4–6].
Как артерии становятся жесткими. Этапы сосудистого ремоделирования
Процесс ремоделирования сосудов включает в себя стадии функциональных и морфологических изменений [7,8], приводящих к нарушению основных сосудистых функций (рис. 1). Основными функциями артериального русла являются проводящая и демпфирующая.
Проводящая функция обеспечивает доставку адекватного количества крови к периферическим тканям в соответствии с их потребностями. Эта функция определяется шириной просвета сосуда. Нарушение проводящей функции связано с сужением или окклюзией сосуда, что приводит к нарушению перфузии тканей ниже места окклюзии.
Демпфирующая функция обеспечивается эластическими свойствами артерий и направлена на гашение колебаний давления крови, создаваемого сердцем. Демпфирование обеспечивает передачу относительно стабильного давления крови периферическим тканям. Кроме того, часть энергии, производимой сердцем во время систолы, аккумулируется в стенках сосудов и расходуется во время диастолы. Нарушение демпфирующей функции связано с увеличением жесткости артериальной стенки, что приводит к повышению систолического и пульсового давления, снижению диастолического давления, ускорению отраженной волны. В результате увеличивается постнагрузка на левый желудочек, развивается гипертрофия миокарда, ухудшается коронарная перфузия [9], нарушается диастолическая функция левого желудочка. Атеросклероз в развернутой стадии является окклюзионным заболеванием и нарушает проводящую функцию артерий, а артериосклероз, вызывая ремоделирование сосудов и нарушая их эластические свойства, негативно влияет на демпферные свойства. Эти процессы являются, по сути, лишь разными формами структурного ответа на метаболические и гемодинамические повреждения [10]. Общим пусковым фактором развития этих патологических процессов является нарушение функции эндотелия, что приводит к нарушению баланса медиаторов вазодилатации и констрикции сосуда и повышению сосудистого тонуса. Длительное существование эндотелиального дисбаланса вызывает гипертрофию и гиперплазию гладкомышечных клеток сосудистой стенки (ГМК), активацию синтеза соединительнотканного матрикса, утолщение медии артерий. Это приводит к нарушению эластических свойств сосуда. Увеличение массы ГМК увеличивает степень вазоконстрикции в ответ на нейрогормоны, приводит к повышению периферического сосудистого сопротивления и способствует стабилизации и усугублению артериальной гипертонии. Утолщение сосудистой стенки, лейкоцитарное пропитывание, механическое повреждение избыточным давлением крови запускают процесс апоптоза эндотелиальных клеток и предрасполагают сосуды к развитию и прогрессированию атеросклероза.
Таким образом, жесткость сосудов является интегральным показателем, определяемым не только структурными элементами сосудистой стенки и давлением крови, но также и регуляторными механизмами, среди которых эндотелиальная дисфункция и активность симпатической нервной системы играют ключевую роль.
Переход в стадию
• Фиброэластическое перерождение морфологических изменений
• Повышение степени вазоконстрикции в ответ на действие нейрогормонов
• ? Стабилизация и усугубление артериальной гипертонии.
• ? Артериосклероз (снижение эластичности сосуда).
• ? Апоптоз эндотелиальных клеток
Рис. 1. Этапы сосудистого
• Атеросклероз
ремоделирования
Характеристики жесткости артериальной стенки в связи с детерминантами ССЗ
Повышение ЖСС, приводящее к преждевременному возврату отраженной волны в поздней систоле, ассоциируется с рядом известных факторов риска ССЗ и патофизиологических состояний.
Накопленные данные, в то же время, противоречивы по ряду позиций и в основном получены на селективных выборках или клинических группах. Принимая во внимание существующие ограничения, нами проведено популяционное исследование ассоциаций показателей пульсовой волны с рядом кардиоваскулярных детерминант. Обследована популяционная выборка из 419 мужчин в возрасте 45–69 лет, жителей г. Новосибирска. Показатели дигитального объемного пульса определяли фотоплетизмографически с помощью прибора Pulse Trace (“Micro Medical”, UK) (рис. 2).
Анализировали параметры индекса жесткости (SI, м/с), (рис. 3а), связанного со скоростью пульсовой волны в крупных артериях, и индекса отражения (RI, %) пульсовой волны (рис. 3б), связанного преимущественно с тонусом мелких артерий.
Для вычисления референсных нормативных показателей SI и RI в изучаемой популяционной выборке 45–69 лет была сформирована группа практически здоровых лиц (без явных сердечно-сосудистых и легочных заболеваний, ожирения и сахарного диабета) по данным клинико-инструментального исследования. В данной группе значения 95% доверительного интервала распределения индексов SI и RI составили 9,3 м/с и 78,5%. Соответственно, при округлении до целого значения рабочими критериями повышенных показателей могут считаться SI > 9,0 м/с и RI > 80%.
Полученные нами сводные данные о выявленных ассоциациях показателей дигитального объемного пульса с различными детерминантами представлены в табл. 1 и 2.
Возраст
Практически все исследования показывают, что такой маркер артериальной жесткости, как скорость распространения пульсовой волны (СРПВ), достоверно увеличивается с возрастом [11–17]. У женщин до 60 лет СРРП достоверно ниже, чем у мужчин, однако к 60 годам показатели выравниваются [11,14]. Зависимость параметров отраженной волны от возраста оценивается противоречиво. В ряде работ была показана положительная ассоциация индекса аугментации (AIx) с возрастом [18], но в недавнем исследовании McEniery et al., 2005 [17] и Фремингемском
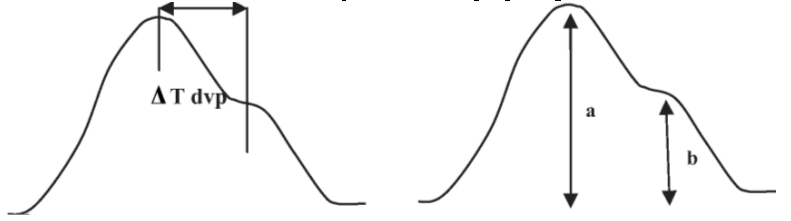
Рис. 3а. Расчет индекса жесткости (SI) по фотоплетизмограмме: SI = Рост пациента/∆T dvp, ∆T dvp – время между пиками прямой (систолической) и отраженной (диастолической) пульсовой волны
Рис. 3б. Расчет индекса отражения (RI) по фотоплетизмограмме:
RI = b/ax100%, а амплитуда систолической пульсовой волны; b амплитуда отраженной волны
Рис. 4. Возрастной градиент индекса жесткости SI у мужчин 45–49 лет (популяционная выборка, Новосибирск)
исследовании [19] получены свидетельства нелинейной связи AIx с возрастом и отсутствии существенного прироста индекса с возрастом у пожилых.
В изученной нами выборке средний показатель индекса жесткости SI у мужчин 45–69 лет составил 9,5±0,14 м/с и последовательно увеличивался с возрастом от 8,4±0,29 м/с в пятилетии 45–49 лет до 10,3±0,30 м/с в старшем пятилетии 65–69 лет, p<0,001 (рис. 4). Наиболее интенсивный прирост значений SI наблюдался при переходе в возрастную группу 60 лет и старше. Величина индекса отражения пульсовой волны, RI в обследованной выборке в среднем составила 77,3±0,46%, существенно не менялась в возрастном диапазоне 45–60 лет и несколько возрастала при дальнейшем увеличении возраста от 76,5±0,06% (в объединенной группе 45–60 лет) до 79,4±1,04% (65–69 лет), р=0,046. По результатам мультивариантной регрессионной оценки (табл. 1) обнаружена линейная зависимость SI от возраста (b=0,102±0,019; p<0,001) и не выявлено линейной ассоциации RI с возрастом (табл. 2) в диапазоне 45–69 лет (b=0,033±0,055; p=0,554).
Артериальное давление
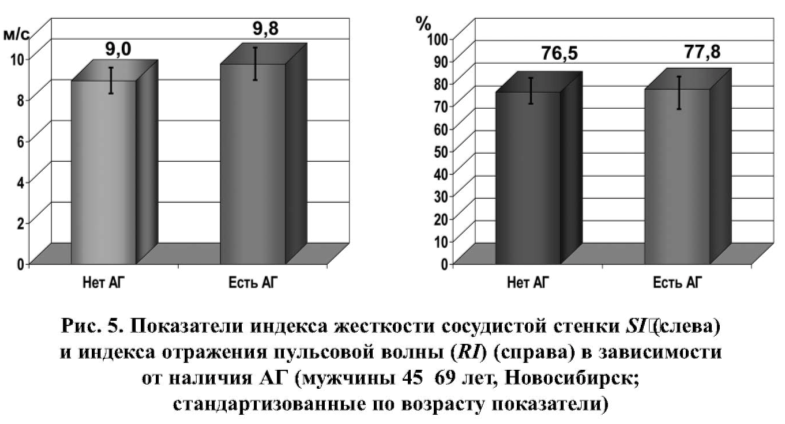
Систолическое и пульсовое давление напрямую зависит от снижения эластичности стенок крупных артерий [20]. В целом ряде исследований показана связь повышения жесткости артериальной стенки с артериальной гипертензией [21,22], преимущественно за счет увеличения систолического и пульсового АД [23]. Lantelme P. et al. (1998) представлены свидетельства ассоциации АД с жесткостью артериальной стенки даже у пациентов с “гипертонией белого халата” [24]. По нашим данным
(рис. 5), полученным в общей популяции, в группе гипертоников индекс жесткости SI был достоверно выше, чем у лиц без АГ, и это различие сохранялось при стандартизации показателей по возрасту: 9,8±0,17 м/с против 9,0±0,21 м/с (p=0,003). По результатам мультивариантного регрессионного анализа (табл. 1) SI линейно ассоциировался с САД (b=0,018±0,006, p<0,001). У нормотоников (рис. 5) показатель RI составлял 76,5±0,76% и лишь незначительно возрастал у пациентов с АГ: 77,8±0,60% (p=0,161). Однако по данным мультивариантного регрессионного анализа (табл. 2) также обнаружена линейная связь RI с САД (b=0,075±0,17, p<0,001). Факт несущественного различия средних показателей RI в группах пациентов с АГ и без АГ может быть связан с тем, что среди гипертоников 37% получали гипотензивную терапию.
Гипотензивная терапия
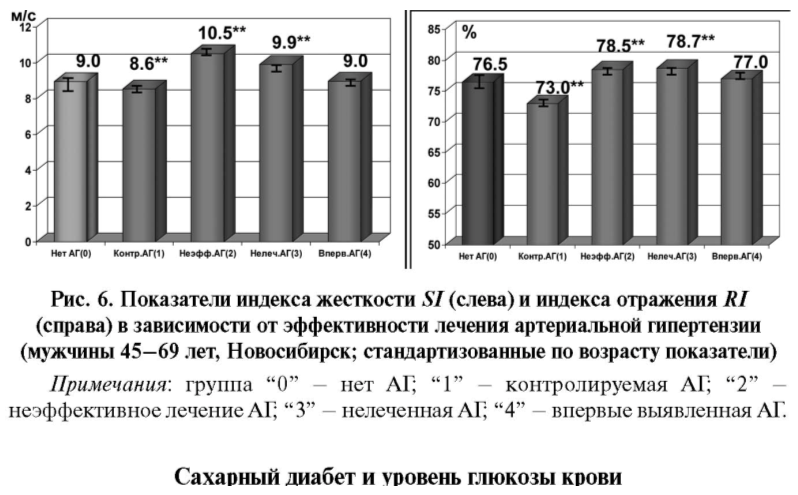
Интервенционными клиническими исследованиями представлены свидетельства снижения артериальной жесткости под влиянием эффективной гипотензивной терапии [25] и показан эффект отдельных препаратов: ингибиторов АПФ [26–28], антагонистов кальциевых каналов [29], антагонистов АТ-II рецепторов [30], β-блокаторов [27], диуретиков [22,31]. При этом существуют свидетельства того, что эффект гипотензивных препаратов в отношении жесткости артерий не связан напрямую со снижением АД или связан не только с этим [26, 30, 32]. В обследованной нами популяционной группе гипертензивных лиц оба показателя, SI и RI, были достоверно ниже при эффективном контроле АД (рис. 6), чем у неэффективно леченных и нелеченных гипертоников независимо от возраста (p = 0,021–0,045).
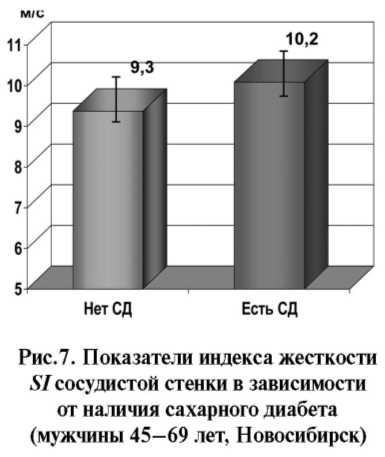
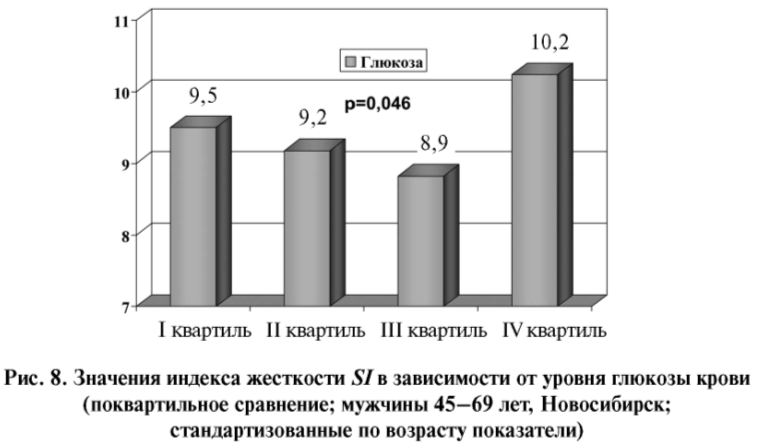
Повышение жесткости сосудистой стенки при сахарном диабете (СД) является следствием комбинации генетических, метаболических и гормональных изменений, причем, увеличение ЖСС у диабетиков развивается раньше, чем проявления ангиопатий. Гликозилирование и его конечные продукты уменьшают эластичность соединительной ткани в стенках сосудов [33, 34], и сосудистая жесткость повышается при СД 1-го и 2-го типа [35–37] и нарушении толерантности к глюкозе [38]. Вместе с тем в отношении молодых пациентов с СД 1 типа получены противоречивые данные [35]. По нашим данным (рис. 7), фотоплетизмографический индекс жесткости сосудистой стенки SI у мужчин с СД составил 10,2±0,42 м/с против 9,3±0,14 м/с у лиц без этой патологии (p=0,040) и ассоциировался с увеличением уровня глюкозы крови на уровне тенденции (b=0,137±0,081; p=0,094) (табл. 1). При поквартильном сравнении значения индекса жесткости были достоверно наиболее высокими в четвертой квартили распределения уровня глюкозы крови (рис.8).
Показатель RI в обследованной мужской выборке существенно не менялся в зависимости от наличия СД.
Курение
Курение негативно влияет на показатели эластичности сосудов [39]. Так, скорость распространения пульсовой волны (СРПВ) повышается непосредственно после выкуривания сигареты и остается повышенным еще в течение 1–2 часов. СРПВ и индекс жесткости стойко повышены у хронических курильщиков [30, 40], причем влияние курения на эти показатели является дозозависимым.
В популяционной мужской выборке нами также обнаружена связь индекса жесткости SI с курением (b=0,380±0,104, p<0,001), независимая от других факторов (табл. 1).
Таблица 1
Ассоциация показателя индекса жесткости SI пульсовой волны
с различными факторами риска сердечно-сосудистых заболеваний
(множественная линейная регрессия; мужчины 45–69 лет, Новосибирск)
b – коэффициент регрессии, SE – стандартная ошибка b, зависимая переменная –SI
Липиды крови
Рядом исследований представлены данные о связи артериальной жесткости с гиперхолестеринемией [41, 42], в том числе при семейной ГХС. По результатам нашего исследования (табл. 2) после учета вклада комплекса факторов риска сохраняется тенденция к ассоциации индекса отражения пульсовой волны RI с уровнем общего холестерина крови (b=0,590±0,351; p=0,094).
Новые и потенциальные детерминанты ССЗ
Помимо влияния классических факторов риска ССЗ на сосудистую жесткость на сегодня большой интерес вызывает эффект новых потенциальных кардиоваскулярных детерминант, таких как маркеры воспаления, метаболические нарушения, уровни оксидантной / антиоксидантной активности, утолщения интимо-медиального комплекса (ТИМК) артериальной стенки, изменения вазореактивности и др. Так, в отдельных работах показана связь артериальной жесткости с гипергомоцистеинемией [43], повышенным уровнем С-реактивного протеина (hsCRP) [44, 45]. При исследовании уровня биомаркеров, в зависимости от параметров жесткости и отраженной волны в популяционной мужской выборке (рис. 9), мы выявили увеличение SI в верхней квартили распределения уровня hsCRP (p=0,046) и нижних квартилях распределения значений α-токоферола (p=0,029).
Проведенные ранее исследования показали, что снижение эластичности сосудов свидетельствует о прогрессировании атеросклероза и ассоциируется с общей распространенностью атеросклеротического процесса [23, 43, 46]. В исследованиях с использованием ангиографии
Таблица 2
Ассоциация показателя индекса отражения RI пульсовой волны
с различными факторами риска сердечно-сосудистых заболеваний
(множественная линейная регрессия; мужчины 45–69 лет, Новосибирск)
b – коэффициент регрессии, SE – стандартная ошибка b, зависимая переменная – RI

I квартиль II квартиль III квартиль IV квартиль
Рис. 9. Значения индекса жесткости SI в зависимости от уровня С-реактивного протеина (поквартильное сравнение; мужчины 45–69 лет, Новосибирск; стандартизованные по возрасту показатели)
показано, что ЖСС увеличивается пропорционально числу пораженных атеросклерозом коронарных артерий [10, 47]. Van Popele еt al. (2001)
[23] в популяционной выборке лиц пожилого и старческого возраста (60–100 лет) показали корреляцию СРПВ по аорте с ТИМК сонных артерий и количеством атеросклеротических бляшек, в том числе среди лиц без предшествующих ССЗ. Мы обследовали популяционную выборку мужчин более молодого возраста (45–69 лет) и получили аналогичные результаты. В частности (рис. 10), величина SI в трех подгруппах
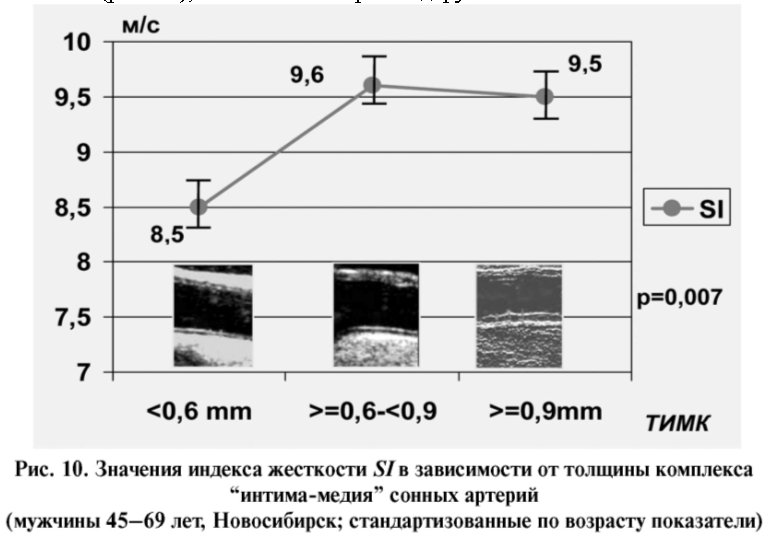
Рис. 11. Значения индекса жесткости SI в зависимости от наличия атеросклеротических бляшек сонных артерий (мужчины 45–69 лет, Новосибирск; стандартизованные по возрасту показатели)
ЧСС, а также имеет очевидную тенденцию к связи с прочими метаболическими факторами: уровнем триглицеридов крови, отношением “окружность талии/окружность бедер”.
• ? Для индекса отраженной пульсовой волны RI в возрастном диапазоне 45–69 лет не выявлено линейной связи с возрастом. Показатель отражения пульсовой волны RI независимо ассоциируется с уровнем систолического АД и ЧСС, а также имеет тенденцию к связи с уровнем общего холестерина.
• ? По результатам анализа фотоплетизмографических показателей дигитального объемного пульса подтверждены негативное изменение жесткостных свойств сосудистой стенки как органа-мишени при АГ, а также благоприятный профиль параметров жесткости в группе эффективного контроля АД по сравнению с неэффективно лечеными или не получающими гипотензивного лечения гипертониками (независимо от возраста).
• ? По результатам анализа некоторых биомаркеров в обследованной популяционной выборке индекс жесткости SI ассоциируется с высоким уровнем С-реактивного протеина (маркера воспаления) и низким уровнем α-токоферола (антиоксидантного витамина). В изученной мужской выборке 45–69 лет не выявлено связи индексов SI и RI с уровнем других антиоксидантных витаминов и уровнем гомоцистеина крови.
• ? Показатели индекса жесткости SI ассоциируются с неинвазивными ультразвуковыми маркерами атеросклероза – утолщением комплекса “интима-медия” и наличием атеросклеротических бляшек сонных артерий, а также с ультразвуковым индикатором эндотелиальной дисфункции (снижением поток-зависимой вазодилатации).
• ? На основании распределения значений SI и RI в популяционной группе практически здоровых лиц 45–69 лет значения фотоплетизмографических индексов жесткости SI >9,0 м/c и отражения RI >80% могут быть рекомендованы в качестве рабочих референсных критериев повышенной артериальной жесткости
Таким образом, фотоплетизмографические сосудистые показатели жесткости и отраженной пульсовой волны ассоциированы с основными и некоторыми обсуждаемыми детерминантами ССЗ. Параметры жесткости артериальной стенки связаны с маркерами генерализованного атеросклероза и эндотелиальной дисфункции, характеризующими как ранние стадии сосудистого поражения, так и риск кардиоваскулярных осложнений. В то же время остаются актуальными выработка нормативов для характеристик сосудистой жесткости в широком возрастном диапазоне для обоих полов, дальнейшие исследования их прогностической значимости в бессимптомной популяции, а также поиски путей эффективной коррекции повышенной артериальной жесткости.
Возможности применения контурного анализа пульсовой волны при неинвазивной оценке структурных изменений сонных и коронарных артерий
Семенкин А.А.
Омская государственная медицинская академия Кафедра пропедевтики внутренних болезней
Нормальная сосудистая стенка состоит из трех слоев с относительно стабильными структурными компонентами и изменчивой функциональной активностью эндотелиальных и гладкомышечных клеток, участвующих в регуляции органного кровотока. При прогрессировании атеросклеротического поражения сосудистой стенки и при старении изменяется как функциональная активность сосудистых клеток, так и структурные компоненты сосудистой стенки, что приводит к изменению физических свойств артерий и, в частности, их эластичности.
Методы оценки эластичности или жесткости артерий приобретают все большую и большую популярность, так как они позволяют оценивать не только структуру, но и функцию сосудов.
Нами были проведены исследования для определения возможностей метода оценки жесткости артерий по выявлению структурных сосудистых изменений, определяемых с помощью наиболее широко используемых в клинической практике методов – УЗИ высокого разрешения и коронарной ангиографии.
В качестве метода оценки жесткости артерий был выбран метод контурного анализа периферической объемной пульсовой волны, регистрируемой фотоплетизмографически с помощью прибора Pulse Trace, 2000.
На рис. 1 представлена пульсовая кривая, регистрируемая прибором. Она состоит из двух компонентов – прямой волны, идущей на периферию от сердца и отраженной от периферических сосудов. В качестве показателя, или индекса жесткости (SI), определяется скорость распространения пульсовой волны, рассчитываемая как отношение роста пациента к временному интервалу между прямой и отраженной пульсовыми волнами (рис. 1). Таким образом, прибор позволяет регистрировать системную жесткость артерий, складывающуюся из жесткости артерий преимущественно эластического и мышечного типа.
Учитывая участие артерий мышечного типа в формировании периферической пульсовой кривой, жесткость артерий и, соответственно, скорость распространения пульсовой волны, регистрируемая прибором, зависит от относительно стабильных структурных элементов сосудистой стенки и вариабельных функциональных, таких как растягивающее давление и тонус гладкомышечных клеток.
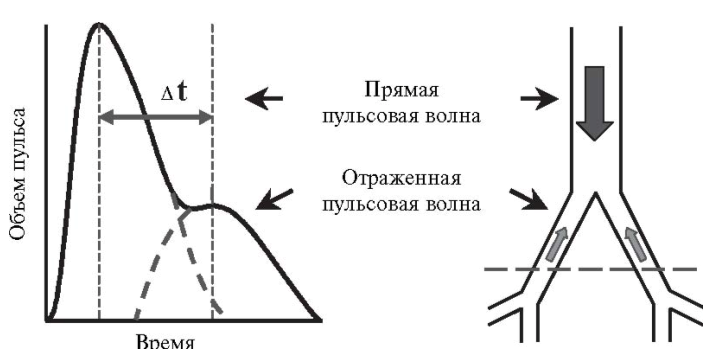
Рис. 1. Оценка жесткости артерий по характеристикам периферической пульсовой волны
Примечание: SI рост/∆t (м/с), где SI индекс жесткости (скорость распростра нения пульсовой волны); рост рост пациента в метрах; ∆t время между пиками прямой и отраженной пульсовых волн в секундах
Наличие функционального компонента жесткости маскирует структурные изменения и обусловливает нестабильность точки отражения пульсовой волны, что может оказывать влияние на воспроизводимость результатов исследования в зависимости от уровня артериального давления и активности систем, регулирующих сосудистый тонус.
Проанализировав данные литературы, мы предположили, что назначение периферического вазодилататора нитроглицерина может устранить проблемы, связанные с функциональным компонентом жесткости за счет снижения растягивающего давления и тонуса гладкомышечных клеток, что, с одной стороны, приведет к стабилизации точки отражения пульсовой волны на более низком уровне и изолированию компонента жесткости, обусловленного структурными элементами сосудистой стенки. На фотоплетизмограмме это проявляется замедлением скорости распространения пульсовой волны, определяемым как увеличение времени между пиками прямой и отраженной пульсовых волн.
В соответствии со стандартной методикой исследование проводится в положении больного лежа. Через 10 мин адаптации регистрируются три пульсовые кривые с интервалом в 1 минуту. В качестве базального индекса жесткости (SIбаз) принимается среднее значение индекса жесткости трех пульсовых кривых. В соответствии с предлагаемой нами методикой 4 пульсовые кривые регистрируются через 2, 3, 4 и 5 мин после сублингвального приема 500 мкг нитроглицерина и рассасывания препарата. В качестве анализируемого показателя (SIнг) используетсясреднее значение индекса жесткости четырех пульсовых кривых после нитроглицерина.
Примечание: ^ – корреляции достоверны при p<0,05; * – корреляции достоверны при p<0,001.
Сопоставление описанной методики и ультразвукового исследования сонных артерий было проведено у 110 добровольцев без сердечно-сосудистой патологии, не получающих какую либо медикаментозную терапии, в возрасте от 18 до 64 лет. Оценивались следующие показатели: уровень артериального давления, липиды, глюкоза крови, толщина комплекса интима-медия в средних сегментах общих сонных артерий, базальный индекс жесткости, индекс жесткости после нитроглицерина.
По данным корреляционного анализа (табл.1) выявлены достоверные положительные корреляции умеренной и средней силы между ТИМ и всеми анализировавшимися факторами риска за исключением триглицеридов и ХЛПВП. Такой же спектр корреляционных связей с факторами риска был выявлен для базального индекса жесткости и индекса жесткости после нитроглицерина. Кроме того, выявлены достоверные связи обоих индексов жесткости с ТИМ. Сильная для индекса жесткости после нитроглицерина и средняя для базального индекса жесткости, а также тесная связь двух индексов жесткости между собой.
При проведении пошагового регрессионного анализа только возраст и систолическое артериальное давление оставались достоверно связанными с показателями ультразвукового исследования и фотоплетизмографии.
Связи ТИМ и базального индекса жесткости с возрастом и САД теряли значимость при коррекции по индексу жесткости после нитроглицерина, так же как и связи базального индекса жесткости с ТИМ.
Таким образом, индекс жесткости после нитроглицерина оставался единственной переменной, достоверно связанной с ТИМ.
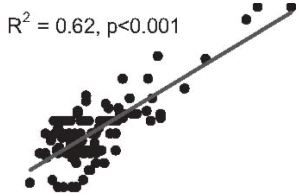
SIнг объяснял большую долю вариабельности ТИМ в сравнении SIбаз (R=0,79, R2=0,62, p<0,001 против R=0,67, R2=0,45, p<0,001 соответственно), достоверность различия коэффициентов регрессий для SIнг, SIбаз и ТИМ была очень высокой (р=0,0000012). Скатерограммы для SIбаз, SIнг и ТИМ представлены на рис. 2 и 3.
1
0.9
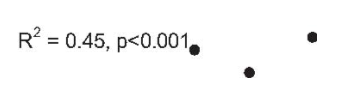
Апробация данной модели была проведена на случайной выборке добровольцев
ТИМ, мм
0.8
0.7
0.6
0.5
0.4

0.3 4 6 8 10 12 14
SIбаз, м/с
Рис. 2. Взаимосвязь между SIбаз и ТИМ
в возрасте от 20 до 50 лет при однократном исследовании ТИМ и индекса жесткости после нитроглицерина. На рис. 4 представлена скаттерограмма, отражающая соотношение индивидуальных предсказанных в соответствии с моделью и измеренных значений ТИМ. Средние значения
ТИМ, определенные ультразвуковым методом, составили 0,576±0,087 мм, рассчитанные по формуле для SIнг – 0,570±0,074 мм (р=0,44), корреляция между показателями – 0,71 (R2=0,51, p<0,001), среднее для разницы между индивидуальными значениями – 0,007±0,051 мм (95%ДИ – 0,010–0,023 мм).
Воспроизводимость показателей жесткости оценивалась на группе здоровых молодых добровольцев в возрасте 18–25 лет с интервалом в одну неделю. У 10 человек одним исследователем и у 10 человек разными исследователями.
Средние значения индексов жесткости при исходном и повторном исследованиях достоверно не различались. Индивидуальная вариабельность индекса жесткости после нитроглицерина в целом по группе составила 5,1%, тогда как вариабельность традиционного индекса жесткости была вдвое выше, что составило 11%.
Вариабельность индекса жесткости после нитроглицерина, определенного разными исследователями, была несколько выше, чем измеренного одним исследователем, однако и она была достаточно низкой (5,7%
против 4,0% соответственно).
1
ТИМ, мм
0.9
0.8
0.7
0.6
0.5
0.4
0.3
2 4 6 810 12
SIнг, м/с
Рис. 3. Взаимосвязь между SIнг и ТИМ
Результаты нашего исследо
вания свидетельствуют, что вос
производимость предлагаемого метода исследования жесткости артерий выше таковой для ТИМ, полученной в популяционных исследованиях. Так, в исследовании R. Salonen et al., вариабельность ТИМ при повторных измерениях одним исследователем составила ±8,3% и разными
ТИМ, мм
исследователями – ±10,5%. 0.9 В исследованиях ACAPS
R2 = 0.51, p<0.001

0.8
и MIDAS различия в повторных измерениях ТИМ составили 0,11 мм и 0,12 мм соответственно, что в применении к значениям ТИМ в нашем исследовании привело бы к различиям между повторными измерениями в пределах 20%.
SIнг, м/с
Учитывая более высокую ква
Рис. 4. Скаттерограмма для индивидуальных
лификацию и мотивирован
измеренных и предсказанных значений ТИМ
ность специалистов УЗИ диагностики в многоцентровых
Примечание: ТИМ (предск.) – значения исследованиях, следует пред-ТИМ, рассчитанные по уравнению линейполагать еще большую вариа-ной регрессии; ТИМ (изм.) – значения бельность ТИМ в клиниче-ТИМ, полученные при ультразвуковом исследовании
Выводы по этому исследованию могут быть сформулированы следующим образом:
1. ТИМ и показатели жесткости артерий, определяемые по характеристикам периферической пульсовой волны, отражают параллельные процессы в сосудистой стенке, индуцируемые факторами риска атеросклероза.
2. Определение индекса жесткости после нитроглицерина имеет ряд преимуществ:
• ? SIнг в сравнении с SIбаз лучше характеризует структурные изменения сосудистой стенки, определяемые при помощи УЗИ;
• ? SIнг более полно отражает воздействие факторов риска на сосудистую стенку в сравнении с ТИМ и SIбаз;
• ? более высокая воспроизводимость как в сравнении с SIбаз, так и с ТИМ.
• ?
3. При подтверждении представленных данных в более крупном исследовании предлагаемый показатель может стать альтернативой ТИМ при индивидуальной стратификации риска и использовании в популяционных исследованиях.
Во втором исследовании оценивались возможности фотоплетизмографии по неинвазивной диагностике коронарного атеросклероза.
В исследование включено 300 больных, проходивших коронарную ангиографию для верификации болевого синдрома либо определения показаний к коронарным вмешательствам. Возраст больных от 19 до 74 лет.
Атеросклероз диагностировался при наличии сужения хотя бы одной коронарной артерии не менее чем на 25%. Спазм коронарных артерий исключался при интракоронарном введении нитратов.
При анализе в качестве зависимой использовалась переменная атеросклероз есть – атеросклероза нет. В качестве независимых переменных оценивались базальный индекс жесткости и индекс жесткости после нитроглицерина. Кроме того, при построении
прогностических моделей использовались дополнительные переменные, относящиеся к факторам риска и не требующие дополнительных процедур для измерения – пол и возраст.
По данным коронарной ангиографии атеросклероз коронарных артерий выявлен у 181 и отсутствовал у 119 больных. Значения базального индекса жесткости и индекса жесткости после нитроглицерина были достоверно выше у лиц, имеющих атеросклеротические изменения коронарных артерий в сравнении с лицами с нормальными коронарными артериями (9,73±2,76 м/с против 7,67±2,08 м/с, p<0,00001 и 7,10±1,28 м/с против 5,57±0,98 м/с соответственно).
На рис. 5 и 6 представлены характеристические кривые для чувствительности и специфичности базального индекса жесткости индекса жесткости, после нитроглицерина по выявлению коронарного атеросклероза.
Площадь под характеристической кривой для индекса жесткости после нитроглицерина составила 82% и была достоверно больше, чем для базального индекса жесткости – 75%, что свидетельствовало о большей диагностической ценности предлагаемого нами показателя по выявлению коронарного атеросклероза (p<0,01). При значениях индекса жесткости после нитроглицерина 4,7 м/с коронарный атеросклероз исключался с вероятностью 95%, а при значениях более 7,7 м/с подтверждался с такой же степенью вероятности.
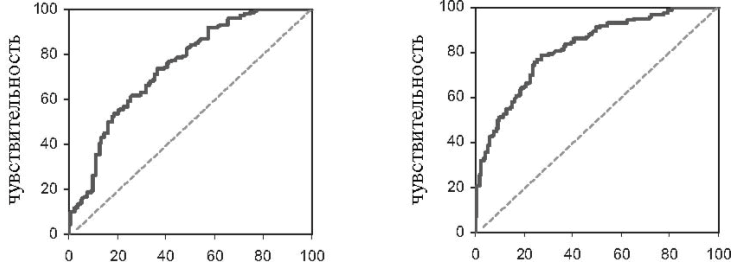
100-специфичность 100-специфичность
Рис. 5. ROC-кривая для Рис. 6. ROC-кривая для чувствительности и специфичности чувствительности и специфичности SIбаз по выявлению коронарного SIнг по выявлению коронарного атеросклероза атеросклероза
Примечание: SIнг – индекс жесткости после нитроглицерина; s – стандартное отклонение
В модели логистической регрессии возраст и пол также являлись значимыми предикторами коронарного атеросклероза (p<0,001 и p<0,005). В данной модели базальный индекс жесткости не был достоверной переменной (p=0,23).
В противоположность этому индекс жесткости после нитроглицерина существенно дополнял модель с высокой достоверностью. Коэффициенты конечной модели, включившей пол, возраст и индекс жесткости после нитроглицерина представлены в табл. 2.
Площадь под характеристической кривой, построенная для вероятностей рассчитанных по уравнению логистической регрессии (рис. 7) составила 87% и была достоверно выше в сравнении с таковой только для индекса жесткости после нитроглицерина. Значение площади под кривой свидетельствовало о высокой диагностической ценности метода. Значения вероятностей для 95% положительной и отрицательной про-100
гностической ценности данной модели были 0,19 и 0,86, соответственно. В табл. 3 показано количество и доля больных, у которых коронар
ный атеросклероз предсказывался либо исключался с 95% вероятностью при использовании базального
чувствительность
80
60
40
20
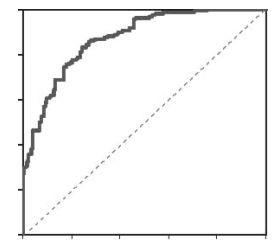
индекса жесткости, индекса жесткости после нитроглицерина и модели для индекса жесткости после нитроглицерина, возраста и пола. С указанным значением вероятности базальный индекс жесткости позволял правильно оценивать состояние
0 0 20 40 60 80 100
100-специфичность
Рис. 7. ROC-кривая для чувствительности и специфичности прогностической модели по выявлению коронарного атеросклероза
Таблица 3 Количество больных для 95% положительной, отрицательной прогностической ценности и точности модели по прогнозированию коронарного атеросклероза
Примечание: ОПЦ – отрицательная прогностическая ценность теста; ППЦ
– положительная прогностическая ценность теста.
коронарных артерий только у 16% больных и выявлять наличие атеросклероза только у 6% обследованных, тогда как индекс жесткости после нитроглицерина позволял диагностировать наличие коронарного атеросклероза у 20% больных (т.е. более чем в 3 раза больше в сравнении с базальным индексом жесткости) при общей точности метода, приближающейся к 30%. В свою очередь регрессионная модель давала правильный ответ практически у половины больных и диагностировала коронарный атеросклероз у 30% больных.
Выводы по данному исследованию:
1. Показатели системной жесткости артерий, определяемые фотоплетизмографически, позволяют прогнозировать наличие коронарного атеросклероза.
2. Тест с нитроглицерином достоверно увеличивает возможности фотоплетизмографии по диагностике коронарного атеросклероза.
3. SIнг дополняет традиционные факторы риска при оценке вероятности атеросклеротического поражения сосудистого русла.
4. Тест с нитроглицерином с определением SIнг может использоваться для проведения скрининговых исследований по выявлению больных с высоким риском развития коронарной патологии.
Заключение
• Предлагаемый нами метод определения системной жесткости артерий при помощи фотоплетизмографии является перспективным методом исследования в кардиологии, позволяющим оценивать структурные изменения сосудистого русла.
• В указанном аспекте данный метод не уступает традиционно использующемуся ультразвуковому методу и превосходит его по воспроизводимости, стоимости и простоте проведения исследования.
• Представленные результаты убедительно обосновывают необходимость оценки данного метода в рамках популяционных проспективных исследований для более точного определения границ его применимости в клинической практике и науке.
Состояние сосудов у женщин перименопаузального периода Майчук Е.Ю., Воеводина И.В, Пиляева Н.Г., Сапунова Д.А.
Кафедра госпитальной терапии №1, МГМСУ
Как известно, повышение жесткости сосудистой стенки отражает процессы сосудистого ремоделирования и рассматривается в числе одного из важных показателей прогрессирования патологии сердечно-сосудистой системы (ССС).
Наряду с методами прямого измерения жесткости сосудистой стенки (определение диаметра и давления на данном участке с использованием ультразвука и катетеризации, метод магнитного резонанса, использование ангиографии), существуют также методики непрямого измерения жесткости (сфигмография, измерение скорости пульсовой волны – СПВ).
СПВ – параметр, интегрирующий геометрию и эластические свойства сосудов, рассчитываются уравнением Моенса–Кортевега, из которого следует, что СПВ возрастает с увеличением жесткости и толщины стенки сосуда. Общеизвестен факт влияния на СПВ возраста и повышения АД.
Кроме вышеприведенных причин, влияющих на величину жесткости сосудов, показана ее связь с длиной теломера (концевого участка хромосомы, показателя биологического возраста), причем были выявлены изменения, свидетельствующие о наличии меньшей жесткости сосудов у женщин аналогичного возраста. Представляет интерес изучение особенностей жесткости сосудов в зависимости от пола пациентов, страдающих наиболее распространенными заболеваниями ССС.
К настоящему времени накоплено достаточно информации об особенностях формирования и течения заболеваний ССС у женщин. Так, показано, что женщины репродуктивного возраста достоверно реже и менее тяжело страдают основными заболеваниями ССС. Кардиопротективный эффект женских половых гормонов распространяется на основные компоненты формирования атеросклеротического поражения, факторы, определяющие основные звенья метаболического синдрома. Постепенная же утрата активности женских половых гормонов вследствие естественной менопаузы или более тяжелое течение хирургической менопаузы после билатеральной овариэктомии лишают сердечно-сосудистую систему женщин этой защиты. К настоящему времени известно, что женские гормоны оказывают разнообразное влияние на сосуды. Так, эстрогены обладают антипролиферативным эффектом на клетки гладкой мускулатуры, снижают синтез коллагена, тогда как прогестерон отвечает за регуляцию тонуса артериол, снижает резорбцию натрия в почечных канальцах (антиминералокортикоидный эффект).
Таблица 1
Распределение пациентов в зависимости от заболеваний ССС
Таким образом, влияние женских половых гормонов на жесткость артерий может быть одним из механизмов, обеспечивающих половые различия риска заболеваний ССС.
С целью изучения особенностей жесткости сосудов у женщин перименопаузального периода, страдающих наиболее распространенными заболеваниями ССС, были обследованы 122 женщины (средний возраст 56, 2±7,2 лет) и 47 мужчин (средний возраст 53, 2±9,6 лет).
Методы исследования с помощьюэлектрокардиографа включали клиническое обследование, проведение ЭКГ, определение липидов и глюкозы, индекса массы тела (ИМТ), измерение АД с вычислением среднего АД (МАР), показатели дигитального объемного пульса методом фотоплетизмографии (Pulse Trace Micro Medical, UK) , анализ параметров индекса жесткости (SI) , связанного с СПВ в крупных артериях, и индекса отражения (RI) пульсовой волны.
Таблица 2
Особенности АД, метаболических показателей у женщин с АГ
в зависимости от показателя индекса ригидности (Si)
и по сравнению с мужчинами с АГ , М ± SD
* – достоверность различий между подгруппами женщин; ** – достоверность различий между мужчинами и женщинами с АГ.
В группу АГ вошло 59 женщин, средний возраст которых был равен 53,3±5,3 лет. В гинекологическом анамнезе из 59 женщин у 34 произведена пангистероэктомия (хирургическая менопауза). В этой группе 25 человек получали в прошлом заместительную гормональную терапию (ЗГТ).
С учетом величины показателя индекса ригидности данная группа была разделена на подгруппы с нормальным (9,3±1,2) и повышенным (12,9±2,2) индексом ригидности.
Таким образом, группу женщин с АГ в целом характеризуют наличие ожирения (ИМТ 29,6±7,4 кг), гипер- и дислипидемии. У половины женщин с АГ сохранена нормальная ригидгность сосудов, между подгруппами имеются различия по величине МАР, отмечена тенденция к более значимым липидным нарушениям у женщин с повышенной сосудистой ригидностью. По сравнению с женщинами, страдающими АГ, у мужчин выявлены достоверно более высокие значения индекса ригидности в целом, а также более значимые показатели ИМТ, САД, ДАД и МАР. То есть у мужчин наблюдались более выраженные нарушения жесткости сосудов, чем у женщин аналогичного возраста, страдающих АГ.
В группу ГБ + ИБС вошло 40 женщин, средний возраст которых был равен 60,4±6,3 лет. Диагноз ИБС подтверждался наличием перенесенного ОИМ, изменениями на ЭКГ, наличием стенокардии. Данная группа характеризовалась повышенным ИМТ (30,2±4,3), 20 женщинам произведено оперативное гинекологическое вмешательство. С учетом величины индекса ригидности группа была разделена на подгруппы с нормальным (10,4±2,1) и повышенным (13,5±1,9) показателем Si (табл. 3).
Таблица 3
Особенности АД, метаболических показателей у женщин с АГ
в сочетании с ИБС в зависимости от показателя индекса ригидности (Si)
и по сравнению с мужчинами с АГ+ ИБС, М ± SD
* – достоверность различий между подгруппами женщин
Анализируя данные, представленные в таблице 3, следует отметить отсутствие гендерных различий изученных показателей, что, по-видимому, объясняется утратой протективного эффекта половых гормонов у женщин в возрасте 60 лет (данные согласуются с общеизвестными статистическими выкладками, свидетельствующими, что именно в этом возрасте женщины не только достигают темпов развития у них заболеваний ССС, но и опережают мужчин по частоте и тяжести осложнений). Несомненно, что факт наличия у пациентов манифестных форм атеросклеротического поражения сосудов сопровождается и наличием выраженных изменений жесткости сосудов, таким образом, атеросклеротическое и артериосклеротическое поражение сосудов в данной группе протекает содружественно.
Несмотря на наличие вышеприведенных данных, следует отметить, что у половины пациенток все еще сохранялись нормальные показатели сосудистой ригидности. Необходимо проведение дальнейших исследований по детальному выявлению в этой подгруппе механизмов, поддерживающих достаточную эластичность сосудов у пациенток с АГ в сочетании с ИБС.
Третью группу составили 23 пациентки, у которых наряду с наличием АГ и ИБС имел место СД 2-го типа, заболевание, оказывающее несомненное влияние как на темпы развития атеросклероза, так и на показатели сосудистой ригидности. Следует отметить, что “добавление ” в данный патологический континуум СД резко изменило частоту
Таблица 4 Особенности АД, метаболических показателей у женщин с АГ в сочетании с ИБС и СД в зависимости от показателя индекса ригидности (Si) и по сравнению с мужчинами с аналогичной патологией, М ± SD
* – достоверность различий между подгруппами женщин ≥0,05.
встречаемости нарушений сосудистой ригидности. Так, если в первых двух группах почти половина обследованных пациенток имели нормальные показатели индекса ригидности, то в 3-й группе этот процент снизился и составил 26%, хотя возраст пациенток с СД был меньше, чем в группе ИБС. Таким образом, заболевание, характеризующееся преимущественными микро- и макроангиопатиями, существенно ухудшает состояние сосудов у женщин, страдающих АГ в сочетании с ИБС. Повышенный индекс ригидности ассоциировался с более выраженными нарушениями липидограммы.
Таким образом:
1. Повышение сосудистой жесткости (ригидности) встречается у половины женщин перименопаузального периода, страдающих артериальной гипертензией .
2. У мужчин сопоставимого возраста, имеющих аналогичную патологию ССС, нарушения жесткости сосудов встречаются чаще, а показатель индекса ригидности достоверно выше.
3. Повышение жесткости сосудов ассоциируется у женщин со значениями среднего АД, нарушениями липидного обмена, у мужчин – дополнительно со значениями САД и ДАД, ИМТ.
4. Присоединение к АГ ишемической болезни сердца во многом нивелирует гендерные различия, вместе с тем у половины женщин сохраняется нормальный индекс ригидности, что обусловливает необходимость дальнейшего изучения структурно-функционального состояния сосудов у женщин с ИБС.
5. Сахарный диабет привел к росту встречаемости нарушений сосудистой ригидности на 25% у женщин с АГ и ИБС.






















